 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
用0.100 mol.L-1NaOH滴定含有0.10 mol·L-1 NH4C1和0.100 mol·L-1HCl混合溶液中的HCl,选择_______
 答案
答案
 请输入或粘贴题目内容
搜题
请输入或粘贴题目内容
搜题
 拍照、语音搜题,请扫码下载APP
拍照、语音搜题,请扫码下载APP
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
 答案
答案
 更多“用0.100 mol.L-1NaOH滴定含有0.10 mol·L-1 NH4C1和0.100 mol·L-1HCl混合溶液中的HCl,选择_______”相关的问题
更多“用0.100 mol.L-1NaOH滴定含有0.10 mol·L-1 NH4C1和0.100 mol·L-1HCl混合溶液中的HCl,选择_______”相关的问题
第1题
为了滴定下列混合酸(碱),各选择一种合适的指示剂: (1)用0.100 mol·L-1NaOH溶液滴定0.100 mol·L-1H2SO4和0.001 0 mol·L-1HAc混合溶液中的H2SO4,选择________为指示剂。 (2)用0.100 mol·L-1HCl溶液滴定0.100 mol·L-1Na2CO3和0.10 mol·L-1NaAc混合溶液中的Na2CO3,选择________为指示剂。
第2题
用0.100 0mol·L-1Na0H滴定20.00mL 0.100 0 mo1.L-1 HAc时,计算不同滴定百分数时溶液的pH值:[Ka(HAc)=1.8×10-5]滴定百分数0.0% 99.9% 100.0% 100.1%pH值________,___________,___________,___________。
第3题
用0.100 0 mol.dm-3的Ce(SO4)2溶液滴定0.100 0 mol.dm-3的FeSO4溶液,计算滴定突跃及理论终点的电势?(已知Eθ(Ce4+/Ce3+)=1.44 V,Eθ(Fe3+/Fe2+)=0.68 V)
第4题
用0.100 mol·L-1NaOH滴定0.100 mol·L-1HA和0.100 mol·L-1HB混合溶液。试计算: (1)化学计量点时溶液的pH值; (2)若要求化学计量点时HB仅有1.0%被滴定,HB的离解常数应为多少? [Ka(HA)=1.1×10-6,Ka(HB)=5.5×10-10]
第5题
用0.100 mol·L-1的NaOH滴定0.100 mol·L-1的弱HB(Ka=1.0×10-5),若终点时的pH=9.0,则终点误差为()。
A.+0.02%
B.0.01%
C.0.02%
D.+0.01%
第6题
第7题
第8题
将0.167 5 g铁配制成100.00mL FeS04溶液,用0.100 0 mol. L -1 Ce(S04)2标准溶液滴定。铂电极作指示电极,SCE电极作参比电极,当加入20.00 mL Ce(SO4):标准溶液时,电池的电动势是多少?化学计量点的电动势是多少?
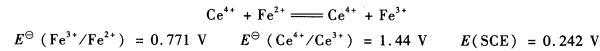
第9题
第10题
第11题