 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
配离子[CrCl3(OH)2(NH3)]2-可能有多少种异构体?
配离子[CrCl3(OH)2(NH3)]2-可能有多少种异构体?
 答案
答案
 请输入或粘贴题目内容
搜题
请输入或粘贴题目内容
搜题
 拍照、语音搜题,请扫码下载APP
拍照、语音搜题,请扫码下载APP
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
配离子[CrCl3(OH)2(NH3)]2-可能有多少种异构体?
 答案
答案
 更多“配离子[CrCl3(OH)2(NH3)]2-可能有多少种异构体?”相关的问题
更多“配离子[CrCl3(OH)2(NH3)]2-可能有多少种异构体?”相关的问题
第1题
(A) Eθ(Ag+/Ag)
(B) Eθ{[Ag(CN)2]-/Ag}
(C) Eθ{[Ag(S2O3)2]3-/Ag}
(D) Eθ{[Ag(NH3)2]+/Ag}
第3题
指出配离子[C0(NH3)6]3+,[C0(en)3]3+和trans一[CrCl2(NH3)4]+中,中心金属的p轨道和d轨道的对称表示。
第4题
AH2SO4,NaOH,HCl;
BH2SO4,NH3,HCl,Cu;
CH2SO4,NaOH,HCl,Cu;
DH2SO4,NaOH,Cu
第5题
(A) [PtNH2NO2(NH3)2]
(B) [Co(NO2)2(en)2Cl2]
(C) K2[Fe(CN)5(NO)]
(D) [PtCl(Br)(Py)(NH3)]
第6题
<wt>“负,负”反应,在______温下正向自发,在______温下逆向自发。<w> <w>
<wt>M3+的3d轨道上有3个电子,表示这三个电子可能运动状态的4个量子数分别为______、______、______、______。<w> <w> <w> <w>
<wt>在电化学腐蚀中,被腐蚀的金属总是做______极,由于极化作用使被腐蚀的金属的φ值______,腐蚀速率减小。<w> <w>
<wt>将0.010dm3、1.0mol·dm-3的氨水和0.010dm3、0.333mol·dm-3的HCl溶液混合,混合液的pH值应为______。[已知
<wt>KMnO4的还原产物,在强酸性溶液中一般是______,在中性溶液中一般是______,在碱性溶液中一般是______。<w> <w> <w>
<wt>NCl3分子中,N原子采用______杂化,分子空间构型为______,分子间力为______。<w> <w> <w>
<wt>25℃时,若将0.010dm3、1.0mol·dm-3的CaCl2溶液和0.010dm3、0.20mol·dm-3的氨水混合后,溶液中c(OH-)=______mol·dm-3,反应商Q=[c(Ca2+)/c]·[c(OH-)/


<wt>若配合物[Pt(NH3)2Cl2]存在顺反异构体,则该配合物的空问构型为______,其中心离子的杂化轨道为______。<w> <w>
<wt>设元素A的原子序数为15,则其核外电子排布式为______,又设元素B原子序数为35,则作用于B原子最外层某一个电子上的有效核电荷数是______;AB3分子的空间构型为______。根据杂化轨道理论,A原子将采______杂化轨道与B原子成键。<w> <w> <w> <w>
<-->
<da>△rHm<0 <da><a>增大 <a>增大 <da>(3)<(1)<(5)<(6)<(2)<(4)
<da><a>浓差 <a>0 <a>0.03V <da>0.52 <da>-0.257V <da><a>5 <a>3
<da><a>1s22s22p63s23p63d54s2<a>d <a>4 <a>ⅦB <a>+7 <a>3s23p63d5
<da><a>sp3<a>sp <a>不等性sp3(或sp3) <a>不等性sp3<da><a>微生物 <a>隔绝氧气
<da><a>低 <a>高
<da><a>3 <a>2 <a>0 <a>1/2
<da><a>阳 <a>升高
<da>9.55
<da><a>Mn2+<a>MnO2<a>
<da><a>不等性sp3杂化 <a>三角锥型 <a>取向力、诱导力、色散力
<da><a>1.33×10-3<a>8.85×10-7<a>无
<da><a>平面正方型 <a>dsp2
<da><a>1s22s22p63s23p3<a>7.6 <a>三角锥型 <a>不等性sp3
第7题
如何制备下列几种盐(以金属Cu,Fe及TiO2,MnO2和CrCl3为起始原料)? Cu(NO3)2,Ti(SO4)2,CuCl,FeCl3,FeF3,Cr2(Ac)4.2 H2O,Mn(Ac)2
第8题
已知配离子[FeF 5 (H 2 O)] 2- 的磁矩为 5.8B.M.,则该配离子的空间构型为________形,中心离子 d 电子的排布方式为________,配离子的晶体场稳定化能为________D q ,估计其分裂能与电子成对能的关系为△ o ________P。
第9题
已知[Co(H 2 O) 6 ] 2+ 的分裂能△ o<电子成对能 p,则其中心离子 d 电子的排布方式为________,该配离子的磁矩约为________b.m.。
第10题
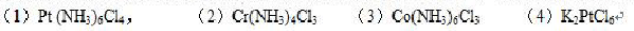
A.(1)>(3)>(4)>(2)
B.(4)>(3)>(1)>(2)
C.(1)>(4)>(3)>(2)
D.(2)>(4)>(3)(>1)