 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
已知:C2H4(g),C(s),H2(g)的燃烧热分别为-1411.2kJ·mol-1,-393.5kJ·mol-1和-285.8kJ·mol-1,试求 (1) C2H4(
已知:C2H4(g),C(s),H2(g)的燃烧热分别为-1411.2kJ·mol-1,-393.5kJ·mol-1和-285.8kJ·mol-1,试求
(1) C2H4(g),H2(g),C(s)的燃烧反应的热化学反应方程式;
(2) C2H4(g)标准摩尔生成热。
 答案
答案





 值:
值: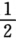 O2(g)→MgO(s) △H5=一601.6 kJ.mol-1 试通过Born—Haber循环计算MgO的晶格能。
O2(g)→MgO(s) △H5=一601.6 kJ.mol-1 试通过Born—Haber循环计算MgO的晶格能。



















