 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
用50.00mL浓度为0.1000mol·L-1的HCl溶液吸收氨气。当一半的酸被中和时,剩余的酸用0.1000mol·L-1NaOH标准溶液
用50.00mL浓度为0.1000mol·L-1的HCl溶液吸收氨气。当一半的酸被中和时,剩余的酸用0.1000mol·L-1NaOH标准溶液进行返滴定,滴定至化学计量点时,pH值是多少?[pKb(NH3)=4.74]
 答案
答案
 请输入或粘贴题目内容
搜题
请输入或粘贴题目内容
搜题
 拍照、语音搜题,请扫码下载APP
拍照、语音搜题,请扫码下载APP
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
用50.00mL浓度为0.1000mol·L-1的HCl溶液吸收氨气。当一半的酸被中和时,剩余的酸用0.1000mol·L-1NaOH标准溶液进行返滴定,滴定至化学计量点时,pH值是多少?[pKb(NH3)=4.74]
 答案
答案
 更多“用50.00mL浓度为0.1000mol·L-1的HCl溶液吸收氨气。当一半的酸被中和时,剩余的酸用0.1000mol·L-1NaOH标准溶液”相关的问题
更多“用50.00mL浓度为0.1000mol·L-1的HCl溶液吸收氨气。当一半的酸被中和时,剩余的酸用0.1000mol·L-1NaOH标准溶液”相关的问题
第1题
A.0.0733mol/L
B.0.0293mol/L
C.0.0147mol/L
D.0.1470mol/L
第2题
A 100mL portion of a 0.1000mol·L-1aqueous solution of the weak acid HA is extracted with 50.00mL of CCl4. After the extraction,a 25.00mL aliquot of the aqueous phase was titrated with 10.00mL of a 0.1000mol·L-1NaOH. Calculate the distribution ratio of HA.
第3题
用50.00cm3浓度为c(HCl)=0.1000mol·dm-3的盐酸溶液吸收氨,当一半的酸被中和时,剩余的酸用c(NaOH)=0.1000mol·dm-3标准碱溶液进行返滴定,滴定至化学计量点时,pH值是多少?
第4题
移取25.00mLNaCl溶液于锥形瓶中,加入25.00mL(AgNO3)=0.1100mol/L的AgNO3标准滴定溶液,用蒸馏水稀释至100.0mL,移取澄清液50.00mL,用c(NH4SCN)=0.09800mol/L的NH4SCN标准滴定溶液滴定至终点时,消耗5.23mL,如果考虑生成的AgCl沉淀对溶液中过量的Ag+有吸附作用,其吸附量相当于c(AgNO3)=0.1000mol/L的AgNO3标准滴定溶液0.10mL。问原来25.00mL试液中NaCl的质量应为多少?
第5题
某试样含有Bi3+,Cd2+两组分,取试液50.00mL,以二甲酚橙作指示剂,用0.01000mol·L-1的EDTA滴定至终点,消耗25.00mL。另取同体积试液加入镉汞齐,使与铋发生置换反应,反应完成后用同浓度EDTA滴定至终点,消耗体积30.00mL,计算试液中Bi3+,Cd2+的浓度。
第6题
用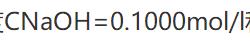 标准溶液和用c(H2SO4)=0.1000mol·dm-3标准溶液滴定同浓度同体积的NaOH溶液,消耗两种H2SO4溶液的体积相同。
标准溶液和用c(H2SO4)=0.1000mol·dm-3标准溶液滴定同浓度同体积的NaOH溶液,消耗两种H2SO4溶液的体积相同。
第7题
需要多少立方厘米浓度为0.1000mol·dm-3的H2SO4溶液,方能使下列碱溶液完全反应:
第8题
第9题
在30.00mLKI溶液中,准确加入10mL0.06000mol·L-1KIO3溶液,再加适量HCl,加热煮沸除去生成的碘。冷却后,加入过量KI,与溶液中剩余的KIO3反应而产生的碘需要用30.00mL浓度为0.1000mol·L-1的Na2S2O3溶液滴定。求原来的KI溶液的浓度和加热煮沸时所除去的I2的质量?[M(I2)=259.2g·mol-1]
第10题
称取土壤样品6.00g,用pH=7.0的1mol·L-1醋酸铵提取,离心,转移含钙的澄清液于100mL容量瓶中,并稀释至刻度。取50.00mL该溶液在25℃用钙离子选择性电极和SCE电极测得电动势为20.0mV,加入0.0100mol·L-1标准钙溶液1.0mL,测得电动势为32.0mV,电极实测斜率(S/n)为29.0mV。计算土壤样品中Ca2+的质量分数。
第11题